
O papel do aleitamento materno para a construção do Microbioma do bebê
O período a partir da concepção até os 2 anos de idade foi denominado de 1000 dias e representa uma janela crítica de crescimento e desenvolvimento do microbioma humano na primeira infância.
O futuro do feto, ainda a ser colonizado, é definido em uma trajetória inicial de montagem da comunidade através da preparação de cada local do corpo pela impressão da mãe no sistema imunológico fetal. Metabólitos como ácidos graxos de cadeia curta (por exemplo, acetato) e outros compostos microbianos podem ser transferidos para o feto através da placenta e influenciar o desenvolvimento imunológico. A dieta e a saúde da mãe também influenciam esses metabólitos, como pode ser visto na figura 1, no painel a.
Logo após o nascimento ocorrem as primeiras etapas na montagem da microbiota corporal do bebê, com os microrganismos competindo para colonizar superfícies internas e externas, se diferenciando em cada local do corpo (figura 1, painel b).
Vários fatores podem influenciar este processo, como: modo de nascimento, amamentação e introdução alimentar, ambiente a que ele está exposto, infecção e uso de antibióticos. Este período é marcado pela rápida maturação das vias metabólicas, endócrinas, neurais e imunológicas do bebê, que se desenvolvem em conjunto e são altamente interdependentes. Quando estas vias são desafiadas por insultos ambientais adversos, como infecção ou subnutrição, a trajetória do desenvolvimento infantil pode ser perturbada.
A microbiota intestinal do recém-nascido tem uma estrutura frágil e se mostra instável devido à sua rápida variação temporal. Isso ocorre principalmente, devido a presença de grandes quantidades de oxigênio no intestino do bebê. A microbiota intestinal na primeira semana de vida é frequentemente dominada por espécies de bactérias anaeróbias facultativas, como Bifidobacterium, alguns Bacteroides e Clostridium spp, além de Proteobacteria (por exemplo, espécies de Escherichia, Klebsiella e Enterobacter, Ruminococcus), além de vírus, archeas e fungos.
Estas bactérias pioneiras esgotam o oxigênio preparando o ambiente intestinal então permitem que outras espécies anaeróbias colonizem o intestino. Elas também produzem os ácidos graxos de cadeia curta (AGCC) que nutrem as células intestinais e reduzem o pH do intestino, contribuindo para a função da barreira intestinal. As bifidobacterias também produzem nutrientes, como as vitaminas B9 e B2, além de algumas subespécies auxiliarem na resposta à vacina no primeiro ano de vida.
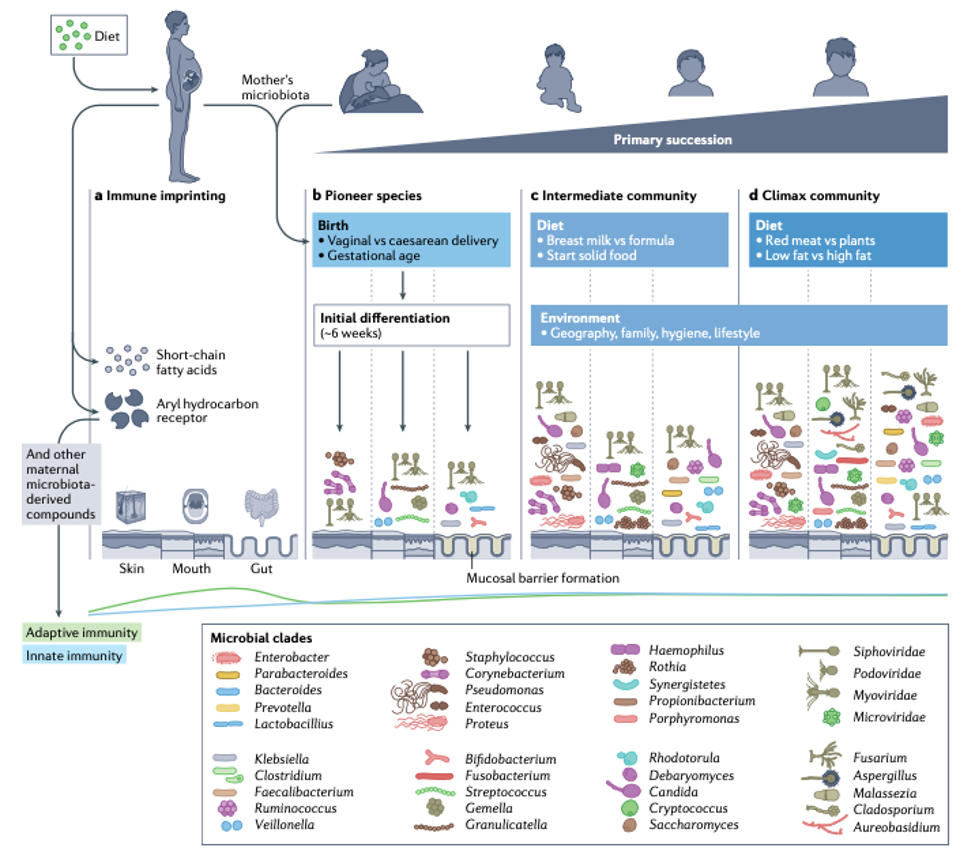
O leite materno desempenha papel fundamental na formação da microbiota intestinal. Estudos identificaram que o leite materno possui variados tipos de bactérias, algumas relacionadas à pele da mãe, que não persistem no intestino do bebê, e são eliminadas em poucas semanas. Outras, como as espécies de Bifidobacterium, que podem colonizar o intestino do bebê.
A composição do leite materno é fundamental para este processo de montagem de microbiota, e diferenças foram observadas entre os bebês amamentados exclusivamente e nos que utilizam fórmula láctea, em relação à composição do microbioma intestinal.
Na composição do leite materno, o principal componente é a lactose, que se liga a outros oligossacarídeos, chamados HMOs (oligossacarídeos do leite humano). Todos os HMOs tem como núcleo a lactose, e então diversas combinações de glicose, galactose, N-acetil galactosamina, fucose e ácido siálico. Estes são frequentemente terminados pela fucose ou ácido siálico, e suas combinações em apenas uma mãe chegam a 100 tipos variados. A formação destas estruturas é individualizada, e cada mãe parece ter uma composição específica destes no seu leite materno. Fatores, como, idade, número de gestações, localização geográfica, estado nutricionais, tradições culinárias e status socioeconômico influenciam no perfil de composição dos HMOs do leite de cada mãe.
Os HMOs possuem quantidades variáveis de antígenos do grupo sanguíneo de Lewis (Le-a, Le-b, Le-x, Le-y), que variam de acordo com a genética de cada mãe. A mães que produzem os epítopos Le-b, são chamadas de “secretoras”, e tem HMOs com mais terminações de fucose. As “não-secretoras” apresentam leite com HMOs com maior proporção de ácido siálico. O leite materno com maior quantidade de fucose, produzida pelas mães “secretoras” está ligado ao enriquecimento acelerado de Bifidobacterium na microbiota intestinal do bebê.
Os HMOs auxiliam na colonização das bifidobactérias, como B. longum, B. breve, B bifidum, B. catenulatum, B. pseudocatenulatum, pois estas bactérias conseguem usar estes carboidratos do leite materno. Algumas espécies de Bacteroides também são consumidoras importantes destes carboidratos. Estes dois gêneros de bactérias, Bifidobacterium e Bacteroides, possuem uma relação importante denominada de alimentação cruzada, do inglês cross-feeding que influencia o microbioma desde a infância, até a idade adulta.
A tendência geral durante a lactação é uma diminuição nos níveis de HMOs totais, à medida que a mãe progride da produção do colostro para o leite maduro, com a maior queda ocorrendo no primeiro mês pós-parto. Mas durante toda a lactação quantidades de cada classe de HMO específicas permanecem constantes e são oferecidas ao bebê.
Em um estudo com mães na Malásia, identificaram que no leite materno das mães cujos bebês apresentaram redução de crescimento havia significativamente menores quantidades de HMOs sialilados e fucosilados, assim como suas microbiotas foram consideradas imaturas. Quando a microbiota deste bebês foi transplantada para animais, estes desenvolveram atraso de desenvolvimento, assim como os bebês. Os oligossacarídeos sialilados estão relacionados com crescimento, desenvolvimento cognitivo, aumento de massa corporal magra, flexibilidade metabólica e crescimento ósseo.
A concentração destes oligossacarídeos no leite humano e no leite cru de animais bovinos tem uma proporção diferente, mas podem ser uma oportunidade de uso quando purificados. Já as fórmulas lácteas são deficientes nestes oligossacarídeos, assim como em anticorpos maternos, lactoferrina e lisozimas.
Tanto a diversidade de bactérias intestinais, como as mudanças na composição foram associadas à proporção da ingestão diária de leite materno, de forma dose-dependente, mesmo após a introdução de alimentos sólidos. Portanto o leite materno é fundamental para o início do desenvolvimento da microbiota intestinal desempenhando funções primordiais para garantir um ótimo desenvolvimento infantil.
REFERÊNCIAS:
ADLERBERTH, I; WOLD, Ae. Establishment of the gut microbiota in Western infants. Acta Paediatrica, [S.L.], v. 98, n. 2, p. 229-238, 12 jan. 2009. Wiley. http://dx.doi.org/10.1111/j.1651-2227.2008.01060.x.
FERNANDEZ-JULIA, Pedro; COMMANE, Daniel M.; VAN SINDEREN, Douwe; MUNOZ-MUNOZ, Jose. Cross-feeding interactions between human gut commensals belonging to the Bacteroides and Bifidobacterium genera when grown on dietary glycans. Microbiome Research Reports, [S.L.], p. 1-12, 2022. OAE Publishing Inc.. http://dx.doi.org/10.20517/mrr.2021.05.
GRITZ, Emily C.; BHANDARI, Vineet. The Human Neonatal Gut Microbiome: a brief review. Frontiers In Pediatrics, [S.L.], v. 3, n. , p. 1-12, 5 mar. 2015. Frontiers Media SA. http://dx.doi.org/10.3389/fped.2015.00017.
GUARALDI, Federica; SALVATORI, Guglielmo. Effect of Breast and Formula Feeding on Gut Microbiota Shaping in Newborns. Frontiers In Cellular And Infection Microbiology, [S.L.], v. 2, n. , p. 1-4, 2012. Frontiers Media SA. http://dx.doi.org/10.3389/fcimb.2012.00094.
MARTINO, C., DILMORE, A.H., BURCHAM, Z.M. et al. Microbiota succession throughout life from the cradle to the grave. Nat Rev Microbiol (2022). https://doi.org/10.1038/s41579-022-00768-z
PANNARAJ, Pia S.; LI, Fan; CERINI, Chiara; BENDER, Jeffrey M.; YANG, Shangxin; ROLLIE, Adrienne; ADISETIYO, Helty; ZABIH, Sara; LINCEZ, Pamela J.; BITTINGER, Kyle. Association Between Breast Milk Bacterial Communities and Establishment and Development of the Infant Gut Microbiome. Jama Pediatrics, [S.L.], v. 171, n. 7, p. 647-655, 1 jul. 2017. American Medical Association (AMA). http://dx.doi.org/10.1001/jamapediatrics.2017.0378.
ROBERTSON, Ruairi C.; MANGES, Amee R.; FINLAY, B. Brett; PRENDERGAST, Andrew J.. The Human Microbiome and Child Growth – First 1000 Days and Beyond. Trends In Microbiology, [S.L.], v. 27, n. 2, p. 131-147, fev. 2019. Elsevier BV. http://dx.doi.org/10.1016/j.tim.2018.09.008.
SHIN, Na-Ri; WHON, Tae Woong; BAE, Jin-Woo. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends In Biotechnology, [S.L.], v. 33, n. 9, p. 496-503, set. 2015. Elsevier BV. http://dx.doi.org/10.1016/j.tibtech.2015.06.011.
SONNENBURG, Justin L.; SONNENBURG, Erica D.. Vulnerability of the industrialized microbiota. Science, [S.L.], v. 366, n. 6464, p. 1-8, 25 out. 2019. American Association for the Advancement of Science (AAAS). http://dx.doi.org/10.1126/science.aaw9255.



